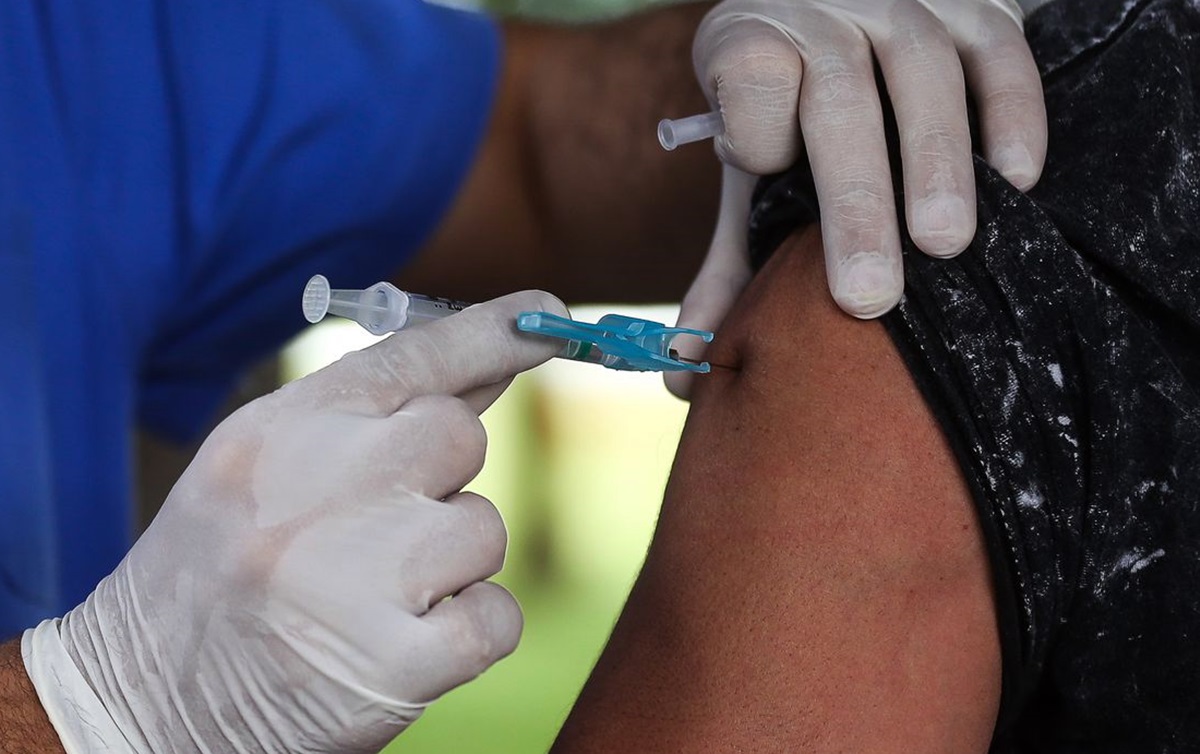
Órgão estabeleceu regras para que empresas solicitem a autorização. Decisão favorável foi unânime entre os diretores
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta quinta-feira (10), a autorização temporária de uso emergencial, em caráter experimental, de vacinas contra a covid-19. O órgão estabeleceu regras para que empresas solicitem a autorização e a decisão favorável foi unânime entre os diretores.
A medida, agora, permite que empresas possam fazer esse pedido de emergência. A diretora da Anvisa Alessandra Bastos Soares explica que a autorização de uso emergencial é um mecanismo que pode facilitar a disponibilização e o uso das vacinas contra a covid-19. “Ainda que não tenham sido avaliadas sob o crivo do registro, desde que cumpram com os requisitos mínimos de segurança, qualidade e eficácia”, disse na reunião.
Entretanto, a Anvisa ainda não recebeu nenhum pedido de uso emergencial da vacina contra covid-19, nem pedido de registro. Alessandra ainda reforçou que esse pedido deve ser feito pela empresa. “Qualquer autorização concedida pela Anvisa, qualquer anuência, só será feita diante de um pleito. A vacina só terá autorização de uso emergencial e experimental se houver o pleito realizado por alguma empresa.”
Vacinas emergenciais
O Reino Unido começou, na última terça-feira (8), a fornecer as primeiras doses da vacina contra a covid-19 da Pfizer, com a BioNTech, após a aprovação emergencial do imunizante no país. Na primeira leva, cerca de 50 hospitais oferecem a vacina para pessoas acima de 80 anos, profissionais do sistema de saúde sob maior risco e funcionários de casas de repouso.
No Brasil, quatro vacinas estão em testes de fase 3: a da Pfizer, a de Oxford, a da Johnson e a da Sinovac. Em dezembro do ano passado, a Anvisa já havia dito que aceitaria que empresas desenvolvedoras de vacinas solicitassem o “uso emergencial” no Brasil.
A agência ressalta que o “uso emergencial” é diferente do “registro sanitário”, que é a aprovação completa para uso de um imunizante. O registro definitivo depende de mais dados e da conclusão de todas as etapas de teste da vacina.
FONTE: REDE BRASIL ATUAL
FOTO: Marcello Casal Junior/EBC